氮气和氧气的沸点(氮气和氧气的沸点谁更高)
氧气和氮气的沸点各是多少
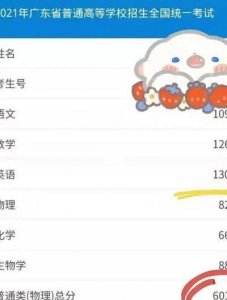
氮气:零下196摄氏度氧气:零下183摄氏度二氧化碳:零下75摄氏度氦在通常情况下为无色、无味的气体;熔点-272°c(升,临界温度-268°c,临界压力26大气压氖(neon)氖是无色、无臭、无味的气体,熔点-2467℃,沸点-105帕),在水中的溶解度5微升/千克水。氩其单质为无色、无臭和无味的气体。759电子伏特。
氮气:冷却至-198℃时,变成没有颜色的液体 冷却至-2086℃时,液态氮变成雪状的固体 氧气:氧气在约-183摄氏度时变为淡蓝色液体 在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气和氮气分别由两个原子组成,分子式分别为02和N2,都是无色、无味、无臭的气体,属于惰性气体,氧气的沸点为183摄氏度,氮气的沸点为负196摄氏度,由于氮气分子中的两个氮原子之间的结合比氧气分子中的两个氧原子之间的结合更强,因此氮气的沸点比氧气更低。
氧气和氮气的沸点分别是-183℃和-196℃。下面将详细解释这两个数值及其背后的原理。首先,我们来了解沸点是什么。沸点是指液体在标准大气压下由液态转变为气态的温度。不同的物质由于其分子间的相互作用力不同,因此具有不同的沸点。
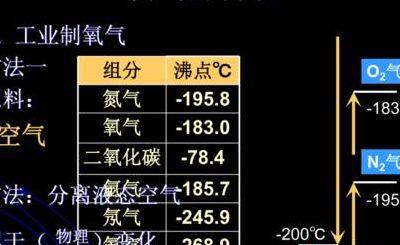
氧气的沸点是-183摄氏度,而氮气的沸点是-198摄氏度。 在分离这两种气体时,首先需要将空气冷却至-198摄氏度以下,使得两种气体都能够液化。 接着,将液化的空气置于-183至-198摄氏度的环境中,液态氧气会先蒸发,而剩下的主要是液态氮气。
氮气在标准大气压(101帕斯卡)下,沸点为-198摄氏度,此时它转变为无色的液体。 继续冷却氮气至-2086摄氏度时,液态氮转变为雪状的固体。 氧气在约-183摄氏度时变为淡蓝色的液体。 进一步降温至约-218摄氏度时,氧气变成雪花状的淡蓝色固体。
氧气和氮气的沸点各是多少?
氮气:冷却至-198℃时,变成没有颜色的液体 冷却至-2086℃时,液态氮变成雪状的固体 氧气:氧气在约-183摄氏度时变为淡蓝色液体 在约-218摄氏度时变成雪花状的淡蓝色固体。
氮气在标准大气压(101帕斯卡)下,沸点为-198摄氏度,此时它转变为无色的液体。 继续冷却氮气至-2086摄氏度时,液态氮转变为雪状的固体。 氧气在约-183摄氏度时变为淡蓝色的液体。 进一步降温至约-218摄氏度时,氧气变成雪花状的淡蓝色固体。
氮气:零下196摄氏度氧气:零下183摄氏度二氧化碳:零下75摄氏度氦在通常情况下为无色、无味的气体;熔点-272°c(升,临界温度-268°c,临界压力26大气压氖(neon)氖是无色、无臭、无味的气体,熔点-2467℃,沸点-105帕),在水中的溶解度5微升/千克水。氩其单质为无色、无臭和无味的气体。759电子伏特。
氧气、氮气的溶沸点
氧气:熔点-214度 沸点-180度 氮气:熔点-2086度 沸点-188度 这是我化学书里找的喔。
NH、HO、HF三者的熔点比较 NH的熔点为-775℃、HO的熔点为0℃、HF的熔点为-35℃。NH、HO、HF三者中,HO的熔点最高,NH的熔点最低。
氧气:熔点-214度 沸点-180度 氮气:熔点-2086度 沸点-196度 二氧化碳的物理性质 二氧化碳是一种无色无味,不可燃的气体,约占空气体积的0.03%(体积)。在自然界中,通过动植物之间的呼吸作用进行循环,二氧化碳是植物成长不可缺少的元素。
氧气熔点-214℃ ,液态氧是淡蓝色的 。氮气在标准大气压下,冷却至-198℃时,变成没有颜色的液体,冷却至-2086℃时,液态氮变成雪状的固体。二氧化碳熔点-56℃(5270帕)沸点-748℃(升华)稀有气体的 氦 熔点-272℃(26个大气压)。沸点-269℃。
分子结构相似,一般以相对分子质量的大小判断沸点大小。相对分子质量越大则沸点就大。查表 氧气:熔点-214℃, 沸点-180℃ 氮气:熔点-2086℃, 沸点-188℃ 氢气:熔点-2514℃,沸点-258℃。
氧气的沸点比氮气的底,为什么在分离这两种气体时氮气
1、氧气沸点是-183℃,氮气是-198℃。如果要分离2种气体,将空气温度降低到-198以下,就可以使2种气体都液化。再将液化空气放入-183~-198℃环境中,液化的氧气就可以再次气化,这样剩下的就基本是液态氮气了,而将气化的空气收集起来再次液化,那就基本是纯氧气了。
2、氮气沸点-198℃ 氧气沸点 -183°C , 液化空气(此时的温度低于-198℃)由低温向高温回升温度,到-198℃时氮气有液态气化为气态,就分离出来了氮气,此时氧气还是以液态存在。
3、没有错啊,沸点低的先蒸发 按照你的数据 先把空气降到非常低的温度,此时所有气体都变成液态 然后缓慢升温 升到了-196℃时氮气先到达沸点,先蒸发了 而氧气还没到沸点 把氮气蒸发完了后再继续升温,才开始分馏氧气 没有错的。
4、氮气的沸点比氧气的沸点高。这一现象是由于分子间作用力的差异造成的。以下是相关解释: 分子间作用力:这种力是影响物质物理性质(例如熔点、沸点等)的关键因素之一。分子间作用力主要包括氢键和范德华力。