等一个肝癌治疗困境的“破局者”
文 | 氨基观察
免疫疗法,这个抗癌界明星已经稳稳地坐在了肝癌治疗的头把交椅上。它不仅让肝癌患者的生存期坐上了 " 延长号 " 快车,更让一线治疗的门槛提高了不少。
但就在我们为免疫疗法的辉煌成就鼓掌的时候,一个棘手的问题悄然出现:
对于那些经过一线免疫联合疗法后病情仍然进展的肝癌患者,接下来的治疗路径应当如何规划与优化?
当前,肝癌二线治疗药物的批准多基于以索拉菲尼为代表的 TKIs 作为一线治疗的背景,对于一线免疫疗法失效的患者,现有二线选项可能并不充分匹配其治疗需求。
虽然全球医学界已经加速钻研,并且拿出了一些初步的研究成果,但疗效上的瓶颈还是像一块大石头压在心头。这是新时代给我们出的一道难题,它提醒我们:
在治疗策略和对疾病机制的理解上,可能还有不少 " 坑 " 要填。
面对这种情况,我们可能需要换个角度,从精准医疗的高地往下看,尤其是那些基于新机制的药物研发,说不定能给这个问题带来不一样的解法,为肝癌患者开辟出一条新的 " 生路 "。
ASCO 之问
作为医学领域最顶级的会议之一,ASCO 总能为医学界带来丰富的启示,同时也引发一系列深入的思考,今年亦是如此。
在 2024 年 ASCO 年会的最后一天,肝癌领域的两项口头报告压轴登场,研究成果的公布备受期待。
其中一项是 III 期研究 CheckMate-9DW,对比了 O 药联合伊匹木单抗(O+Y)与仑伐替尼或索拉非尼的疗效。
另一项是由 USC 的 Anthony 教授汇报的研究,探讨了瑞戈非尼联合帕博利珠单抗在一线免疫治疗进展后的患者的疗效。
这两项研究结果的公布,激发了医学界对肝癌治疗现状的进一步思考。
在 "O+Y" 组合之前,阿替利珠单抗 + 贝伐珠单抗方案已经确认了免疫疗法作为肝癌一线疗法的地位,但 CheckMate-9DW 研究进一步提示了免疫疗法在肝癌一线疗法的临床价值。
数据显示,"O+Y" 组合的中位 OS 达到 23.7 个月," 这是我们在晚期 HCC 中观察到的最长的中位 OS 之一。" 德国美因茨大学医学中心的医学博士 Peter R. Galle 博士说。可想而知,今后免疫疗法在肝癌一线治疗中的地位将更加稳固。
而另一项由 Anthony 教授汇报的研究之所以受到关注,原因在于肝癌免疫治疗之后的二线数据非常有限,而且该研究旨在一个领域内备受关注的问题 " 在一线免疫治疗失效后,二线再次使用免疫 +TKI 的策略是否可行?"。此研究是首个发布免疫 +TKI 在一线免疫之后的可观样本量的前瞻性研究结果,因此非常值得期待。
具体来说,该研究分为两个队列:队列 1 仅纳入了接受现行一线标准治疗(阿替利珠单抗联合贝伐珠单抗)后疾病进展的患者;队列 2 则纳入了接受其他任意免疫检查点抑制剂治疗后疾病进展的患者,不论之前是单药还是联合治疗。
只是,略微遗憾的是,该研究结果不尽如人意。
研究结果显示,在队列 1 中,瑞戈非尼联合帕博利珠单抗的最佳客观缓解率仅为 5.9%,68 例患者中只有 4 例对该方案有响应;队列 2 的结果略好,但最佳应答率也只有 11.1%。安全性方面有 56% 的患者发生 3 级及以上不良事件。由此可见,免疫治疗之后再次使用免疫 +TKI 的策略似乎很难奏效。
这两项在 ASCO 上公布的肝癌治疗前沿研究,实际上突显了一个严峻的现实:
随着以免疫联合治疗为主的一线方案的获批,肝癌后线治疗的前景变得愈发不明朗,一方面既往索拉非尼治疗后的数据在临床上的适用性被打上了大大的问号,另一方面二线继续免疫联合 TKI 疗法似乎收效甚微。当前,对于那些对初始免疫治疗响应不佳或产生耐药的患者,临床实践中的治疗路径亦亟需重新评估和创新。
囚徒之困
在肝癌治疗领域,随着一线免疫联合疗法逐渐成为标准策略,后线治疗环节遭遇了一个显著的 " 囚徒困境 ":
尽管抗血管生成的 TKIs 与免疫疗法在前线治疗中扮演着核心角色,但在经历免疫治疗后的患者群体中,这些疗法的持续效用面临严峻考验。
具体而言,TKIs 如瑞戈非尼在接续阿替利珠单抗联合贝伐珠单抗治疗后的表现不尽人意。
2023 年欧洲肿瘤内科学会(ESMO)会议上披露的前瞻性研究表明,针对已完成阿替利珠单抗联合贝伐珠单抗一线标准治疗的患者,瑞戈非尼的 ORR 低至 10%,凸显了其局限性。
此现象并非瑞戈非尼独有,其他先前作为一线疗法基石的药物,包括索拉非尼和仑伐替尼,在类似情况下也显现出了相似的困境。
例如,尽管仑伐替尼单药在三期研究中显示了对初治患者的良好疗效,2023 年《Oncology》杂志发表的一项回顾性分析指出,仑伐替尼用于一线免疫疗法进展后患者的 ORR 仅为 15.4%,进一步证实了这一难题的普遍性。
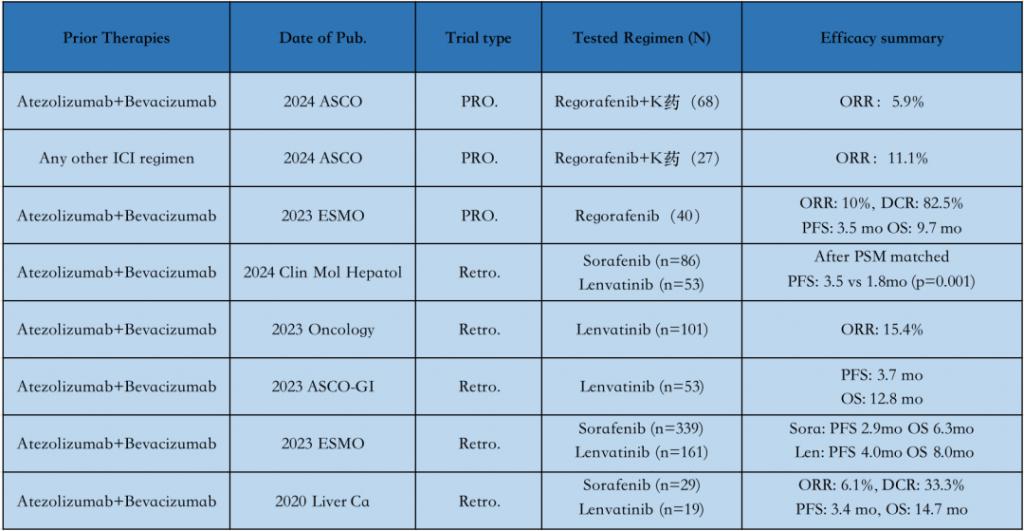
与 TKIs 相比,在 HCC 患者中,先前基于 ICI 的治疗失败后重新试验 ICI 的研究较少。但现有的少数回顾性研究,同样验证了 Andrew 教授研究的结论,即再次启用 ICI 以期获得积极治疗反应的难度。
这不仅体现了二线重复 ICI 和抗血管生成治疗的挑战,也加剧了后线治疗决策的不确定性,尤其对于索拉非尼等药物在临床中的后续适应性产生了疑问。
正如上文所说,现有二线选项并不充分匹配其治疗需求,导致临床实践中治疗方案的选择更多依赖于医生的个体判断而非坚实的循证医学证据。
但实际上,今年 3 月份 ASCO 更新的《晚期肝细胞癌的全身治疗》中,不管是 TKIs 还是 ICI 作为 ICI 治疗失败后的二线治疗,都是 " 证据质量低、推荐强度弱 "。
因此,如何为一线免疫治疗后疾病进展的 HCC 患者设计有效的后续治疗方案,成为了亟待解决的关键问题。
时代之问
肝癌患者在一线免疫疗法之后,通常面临着迫切的治疗需求。
目前,一个非常明确的问题是,在肝癌的一线治疗中,免疫疗法可能因多重机制导致原发性或继发性耐药的产生。这些机制可能包括肿瘤微环境的抑制作用、免疫检查点的过度表达,以及肿瘤细胞的免疫逃逸策略等。
真实世界的研究显示,原发性或继发性耐药患者在所有患者中占有相当比例,并且他们的生存预后通常较差。
例如,今年 ASCO 会议上发表的一项研究揭示,在长达 22.8 个月的随访期内,接近 80% 的受试者对一线免疫治疗产生耐药,凸显了该问题的严峻性。
因此,探索如何为一线免疫疗法后疾病进展的肝癌患者提供更有效的治疗手段,已成为当前亟待解决的紧迫问题,这也是国内医疗领域所面临的挑战。
一方面,随着本土创新能力的飞跃,经济实惠的国产创新免疫疗法药物不断涌现,显著提高了肝癌一线免疫治疗的普及率。
据《觅健肝癌患者生存质量调查 2022》显示,两年间肝癌患者接受免疫治疗的比例增长了两倍,达到 44.7%,标志着免疫疗法在国内的应用显著扩张。
另一方面,随着中国医疗水平的不断提高,接受后线治疗的肝癌患者比例预计会迅速增加。虽然目前暂未有明确的调研数字,但基本属于 " 共识 "。秦叔逵教授在中国原发性肝癌临床登记调查 2022 年生存分析更新报告上就表示,近年来随着含奥沙利铂的系统化疗和靶免药物及其联合方案的应用,肝癌患者接受系统治疗的占比有望进一步提高。
在这样的背景下,无论是在中国还是全球范围内,如何解答这一时代问题,都值得我们深思。
破局之解
历史经验告诉我们,面对肝癌治疗的新挑战,我们可能需要打破传统思维框架。
尽管目前肝癌治疗领域已有多种药物上市,它们大致可以分为两类:一类是针对 PD-1/L1 的免疫检查点抑制剂,另一类是以抗血管生成为主要作用机制的多靶点(主要针对 VEGFR)酪氨酸激酶抑制剂和抗 VEGF 单抗。
确实,这两类药物在过去极大地推动了肝癌治疗的发展。但现在,为了解决一线免疫疗法治疗后疾病进展的肝癌患者的迫切需求,我们还需要继续探索新的治疗策略。
或许,探索具有新颖作用机制的药物显得尤为重要。当前,肝癌耐药的核心难点在于肿瘤微环境的动态适应性,以及肿瘤内部高度的异质性,这些因素共同促成了治疗抵抗的发生,构成了 HCC 治疗的一个难以逾越的障碍。
因此,找到一个不同于以上两者的新的驱动信号通路,或者调节和校准免疫微环境可能是切实可行的方法。这包括利用目前正在临床前测试的小分子蛋白激酶抑制剂,例如 FGFR 抑制剂、TGF β 抑制剂等。这些抑制剂的主要目标是靶向激活的 CTNNB1 通路以促进免疫浸润,或靶向高表达的 VEGF 以实现血管正常化,进而改善肿瘤缺氧状况并促进更有效的免疫浸润。
一些提前布局的产品通过前瞻性临床试验取得的初步结果表明,这类新的精准治疗药物具有巨大的潜力。
例如,和誉医药研发的 FGFR4 抑制剂依帕戈替尼(Irpagratinib,ABSK011)在 2023 年 ESMO 大会上公布的数据,疗效就远超现有疗法。在 27 例既往接受过治疗的 FGF19 过表达的肝癌患者中(其中 64% 的患者曾接受过免疫治疗):
依帕戈替尼的 BID(每日两次)队列,客观缓解率(ORR)达到了 40.7%(11/27)。并且,相当多的病人在接受 ABSK011 前,已经使用过免疫为基础的各类系统治疗。这表明依帕戈替尼的潜在疗效明显优于瑞戈非尼等现有药物组合。
在安全性方面,依帕戈替尼也展现出了独特的优势,其不良反应类型与抗血管药物不同,在临床上更易于管理。
单药可能还不是依帕戈替尼使用的全部场景。依帕戈替尼与阿替利珠单抗的联合治疗也在探索之中,这种联合可能发挥出协同效应,带来 1+1 大于 2 的治疗效果。
目前,关于依帕戈替尼与阿替利珠单抗联合治疗的具体信息还不多。据公开信息,相关联用数据将在 2024 年 6 月的 ESMO GI 大会上公布。对于期待肝癌后线治疗市场早日迎来突破的人们来说,这无疑是一个值得期待的消息。